講演会記録集 2型糖尿病合併CKDにおけるMRAの役割
Introduction
糖尿病に伴う腎障害は、糖尿病合併症の中でもリスクが高く、早期から注意深い管理が求められる疾患である。疾患特異的な治療法の開発が進む中、残余リスクの一因としてミネラルコルチコイド受容体(MR)の過剰な活性化に注目が集まるとともに、治療選択肢として非ステロイド型MR拮抗薬(MRA)が登場するなど糖尿病性腎臓病(DKD)治療は新たな局面を迎えている。
本Webカンファレンスでは、MRの過剰活性化が臨床的にどのような意義を持つのか、さらに非ステロイド型MRAであるフィネレノンを日常臨床でいかに活用するかについて、専門医から最新の知見が提供された。ここではその模様を紹介する。
心腎連関におけるMR阻害の意義
西山 成 先生 香川大学医学部薬理学教室 教授
Key point
- Na+はRAAS非依存的にMRの過剰活性化を惹起し、臓器障害を生じる
- 非ステロイド型MRAフィネレノンはMRの過剰活性化による炎症や線維化を抑えることで心血管・腎障害の発症・進展を抑制する
ミネラルコルチコイド受容体(MR)の活性化が臓器障害を惹起
MRは心血管組織や腎臓に発現し、MRの過剰な活性化は心血管組織においては心不全や心筋線維化、冠動脈疾患などの心血管障害を、腎臓ではアルブミン尿や腎線維化などを惹起して腎障害を生じる1)。
MR活性化のメカニズムとして、古典的にはレニン-アンジオテンシン-アルドステロン系(RAAS)を介したアルドステロン依存性の経路が知られているが、近年、高血糖や肥満、食塩(Na+)の過剰摂取などによって惹起される、RAAS非依存性の新たな経路の存在が明らかとなった(図1)1)。
Na+は転写調節因子であるRas‒related C3 botulinum toxin substrate 1(Rac1)の活性化などを介してRAAS非依存的にMRの過剰活性化を惹起すると考えられている2)。
さらに、原発性アルドステロン症患者では皮膚にNa+が蓄積することが報告されている。しかし、責任病変のある副腎を摘出すると、皮膚のNa+含有量が低下したことから3)、MRの活性化がNa+の蓄積に関与していると考えられた。また、透析患者では骨格筋や皮膚にNa+の蓄積が見られ、Na+の含有量に相関して血中の炎症マーカーも上昇していることから4)、Na+が蓄積する組織では炎症が生じやすいことが示された。つまり、Na+の蓄積がMRを過剰に活性化させて臓器障害を生じ、その臓器障害によるMRのさらなる活性化を介してNa+の蓄積が増強されるという悪循環の形成が想定される。
また、高血糖下ではMRの分解が低下したり、MRへの感受性が高まることが知られている。つまりNa+の蓄積と高血糖が重なる糖尿病の病態は、MRの活性化を増強することが懸念される5-6)。
このような病態に対する治療として、臓器保護作用が期待できるレニン-アンジオテンシン系(RAS)阻害薬の投与が考えられる。しかし、Na+過剰の状態下ではRAASが抑制されるため、RAS阻害薬の効果が減弱する可能性がある。一方、MR拮抗薬(MRA)はMRに直接作用してその過剰活性化を抑制することから有望な治療選択肢の1つとして期待できる。
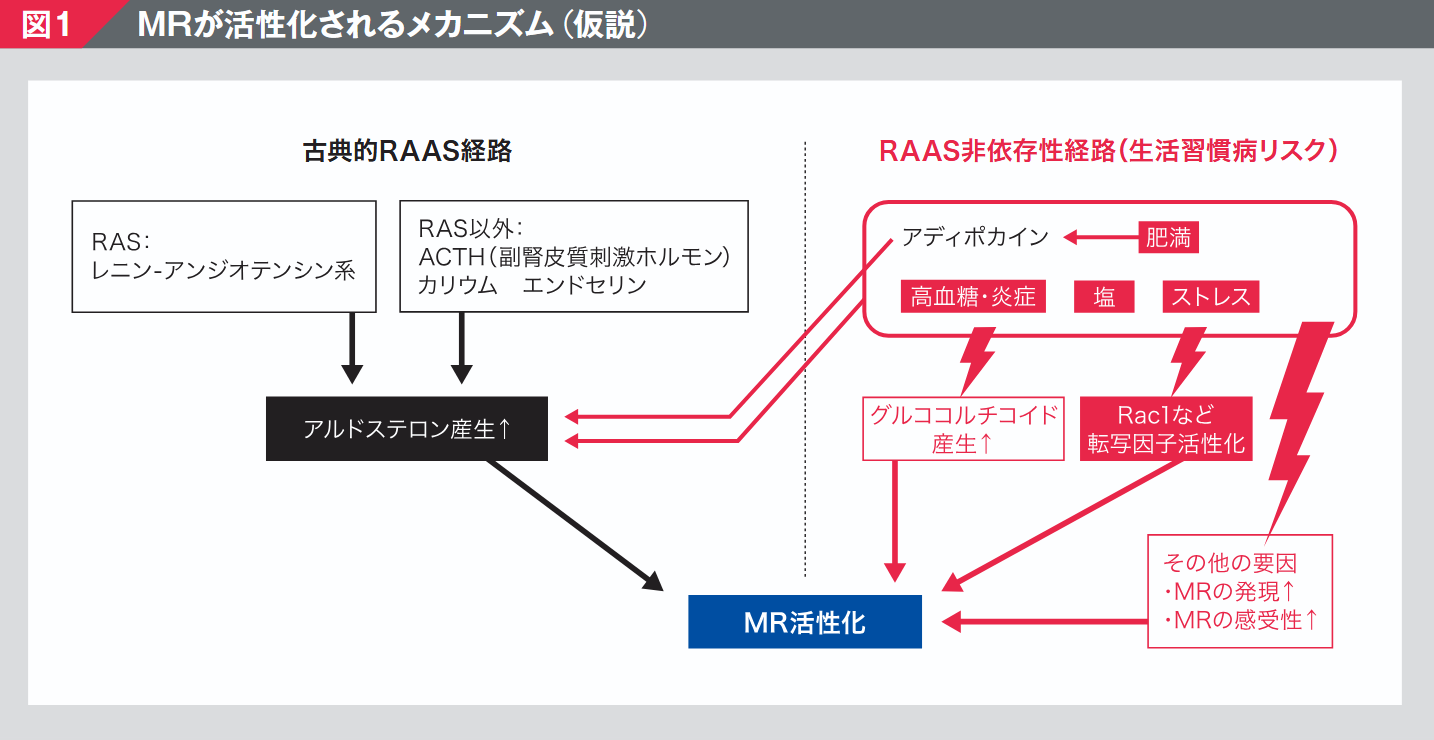
(Nishiyama A. Hypertens Res 2019 ; 42 : 293 -300を改変)
非ステロイド型MRAフィネレノンの特徴
新たに登場したMRAフィネレノンは、既存のMRAと異なりステロイド骨格を持たない。そのオリジンはジヒドロピリジン系カルシウム拮抗薬(CCB)である。
私たちの研究で、ジヒドロピリジン系CCBのアゼルニジピンはアルドステロンと食塩水で高血圧と腎障害を惹起した片腎摘出ラットの血圧を正常化し、腎障害を改善した7)。一方で、非選択的な降圧薬であるヒドララジン投与では血圧は正常化したものの、腎障害の病態改善は不十分であった。この結果から、ジヒドロピリジン系CCBには降圧以外に腎保護に働く作用があることが示唆された。また、ジヒドロピリジン系CCBはMRのリガンドポケットに入り込み、アルドステロンの作用をブロックするとの報告もある8)ことから、ジヒドロピリジン系CCBはMRとアルドステロンの結合を阻害しMRの過剰な活性化を抑制することで、腎保護に寄与すると考えられた。このジヒドロピリジン系CCBであるニフェジピンをリード化合物として誕生したのがフィネレノンである。
非ステロイド型MRAフィネレノンの薬理学的特徴として、MRへの高い選択性が挙げられる。アンドロゲン受容体やグルココルチコイド受容体、プロゲステロン受容体、エストロゲン受容体に対する50%阻害濃度(IC50)は約10,000nMであるのに対し、MRに対するIC50は17nMであった9)。ラットを用いた検討では、腎臓組織と心臓組織に均等に高濃度で分布するという薬物動態学的特徴も見られた10)。
MRはアルドステロンと結合すると核内に移行して転写因子として働き、さまざまな遺伝子の発現を誘導または抑制する。MRAはMRとアルドステロンとの結合を阻害してMRの転写因子としての機能を抑制するが、影響を受ける遺伝子の種類は薬剤によって異なることが報告されている。MRが発現したヒト尿細管細胞にアルドステロンを投与し、フィネレノンとスピロノラクトンが遺伝子発現にどのような影響を与えるのかを調べた研究では、どちらか一方の薬剤のみによって発現の誘導あるいは抑制を阻害される遺伝子の存在が明らかとなった。特に、アルドステロンによって発現が誘導された143個の遺伝子のうち29個がフィネレノンでのみ阻害され、その多くは炎症や線維化に関わる遺伝子であった(図2)11)。また、末梢臓器障害を伴うDOCA-salt誘発高血圧ラットモデルにフィネレノンを投与し、収縮期血圧および腎皮質におけるアルドステロン依存性の炎症、線維化およびリモデリングのマーカー遺伝子の発現を検討した研究では、フィネレノンが収縮期血圧に影響を及ぼさない用量で、腎臓の炎症、線維化およびリモデリングマーカー遺伝子であるプラスミノーゲン活性化抑制因子-1(PAI-1)やオステオポンチン、マトリックスメタロプロテイナーゼ-2(MMP-2)の発現を用量依存的に低下させた10)。
このように、非ステロイド型MRAであるフィネレノンはMRに選択的に作用し、炎症や線維化を引き起こすMRの過剰活性化を抑えることで、臓器障害の発症や進展の抑制に効果を示す薬剤として期待される。

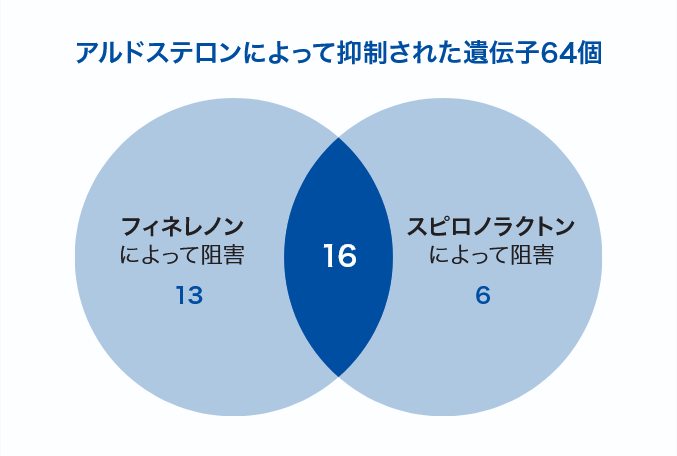
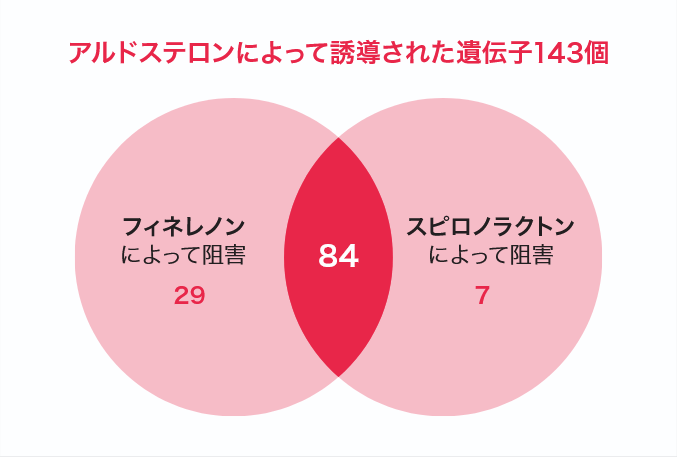
- 試験方法:MRを安定的に発現するヒト腎皮質細胞株を用いて、フィネレノンとスピロノラクトンがアルドステロン誘導トランスクリプトームに及ぼす影響をRNA-シークエンスにより解析した。
- 解析結果:ヒト腎皮質細胞株からアノテーション(ラベル付け)を行った33,287の遺伝子から、既知の遺伝子21,706を抽出。アルドステロンによる発現がフィネレノンもしくはスピロノラクトンに強く誘導もしくは抑制された遺伝子207を選出し、上図のように同定した。
(Le Billan F, et al. FASEB J 2021; 35: e21314より抜粋)
参考文献
1)
Nishiyama A. Hypertens Res 2019;42:293-300.
2)
Shibata S, et al. Mol Cell Endocrinol 2012;350:273‒280.
3)
Kopp C, et al. Hypertension 2012;59:167-172.
4)
Sahinoz M, et al. Nephrol Dial Transplant 2021;36:1307‒1317.
5)
Hayashi T, et al. Int Heart J 2017;58:794-802.
6)
Mitsuishi Y, et al. Mol Cell Endocrinol 2018;473:89-99.
7)
Fan YY, et al. J Hypertens 2009;27:1855-1862.
8)
Dietz JD, et al. Hypertension 2008;51:742-748.
9)
承認時資料:バイエル薬品社内資料
10)
Kolkhof P, et al. J Cardiovasc Pharmacol 2014;64:69‒78.
11)
Le Billan F, et al. FASEB J 2021;35:e21314.
COI:9)の研究はバイエルの資金により実施された。また、著者にバイエルの社員およびバイエルよりコンサルタント料などを受領している者が含まれる。







